

近日,孔令义/张超/余培团队在一流期刊 Nature Nanotechnology 发表题为“Biomimetic vesicles engineered from modified tumour cells act as personalised vaccines for post-surgical cancer immunotherapy”的研究论文,系统提出了一种基于天然产物介导肿瘤细胞重编程的术后转移性癌症个性化自体疫苗新策略,为术后免疫治疗的快速、精准实施提供了全新解决方案。我校中药学院余培副研究员、2020 级硕士研究生金智伟为论文共同第一作者;我校孔令义教授、张超研究员为共同通讯作者;中国药科大学为唯一通讯单位。
手术切除仍是大多数实体瘤的首选治疗方式,但术后残留或隐匿的转移性肿瘤细胞是肿瘤复发和癌症相关死亡的主要根源。个性化癌症疫苗,尤其是树突状细胞(DC)疫苗,被认为是清除残余肿瘤细胞的理想手段。然而,传统 DC 疫苗存在制备流程复杂、成本高、体内迁移与存活能力有限等瓶颈。近年来,人工细胞源性囊泡(ACDVs)被视为 DC 疫苗的潜在替代方案,但其临床转化仍面临一个核心挑战:患者特异性肿瘤新抗原高度异质且难以预测,限制了真正“快速、个性化”疫苗的构建。
围绕这一关键科学问题,孔令义教授团队基于近年来在肿瘤囊泡(包括外泌体及人工囊泡)领域的系统研究积累(Journal of Controlled Release, 2025;Molecular Cancer, 2024;Acta Pharmaceutica Sinica B, 2024;Pharmacological Research, 2024),提出了一条全新的技术路线:直接将手术切除获得的自体肿瘤细胞重编程为具有抗原呈递功能的 DC 样细胞,从源头构建个性化疫苗载体。研究发现,肿瘤细胞中低表达、而在免疫细胞(尤其是 DC)中高表达的关键分子STX11,能够显著上调肿瘤细胞膜上的 MHC I 及共刺激分子 CD80/CD86。通过诱导 STX11 过表达,研究团队成功获得了 MHC Ihigh/CD80high/CD86high的 DC 样肿瘤细胞,并利用其细胞膜构建人工 DC 样细胞来源的囊泡疫苗。该策略在完整保留患者特异性肿瘤抗原库的同时,引入明确的免疫共刺激信号,实现了抗原限制性的 CD8+ T 细胞激活,并在多种术后转移模型中表现出显著的抗肿瘤效果(图1)。
团队发挥天然药物化学研究优势,充分利用天然产物的特点,通过多学科交叉,进一步解决了个性化疫苗“制备速度”这一临床关键瓶颈。研究筛选并发现了天然小分子-去氧鬼臼毒素(DPT),可作为 STX11 基因工程策略的功能替代物,快速诱导肿瘤细胞获得 DC 样特征。基于 DPT 的小分子重编程策略显著缩短了疫苗制备时间,同时保持了与基因工程策略相当的治疗效果,大幅提升了术后个性化免疫治疗的临床可行性。该研究将天然产物调控、肿瘤囊泡工程与个性化肿瘤免疫治疗有机融合,系统展示了从机制发现、疫苗构建到术后转移模型验证的完整研究链条,为术后转移性癌症的快速响应式免疫治疗提供了具有转化潜力的新策略。
该研究得到国家自然科学基金面上项目与青年项目、四大慢病国家科技重大专项、江苏省卓越博士后项目、中央高校基本科研业务费等科研项目的资助。
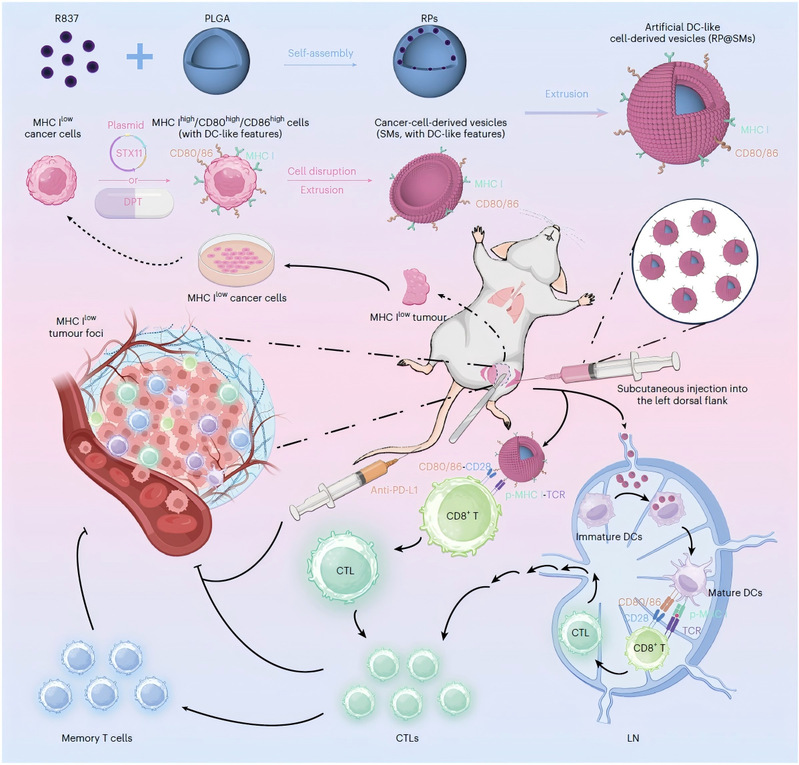
图1人工 DC 样细胞来源囊泡的构建及天然产物介导的术后转移性癌症个性化自体疫苗示意图
全文链接:https://www.nature.com/articles/s41565-025-02113-w
CopyRight CPU ZHONGYAOXUEYUAN [ 中国药科大学中药学院主页] All Rights Reserved
地址:江苏省南京市江宁区中国药科大学中药学院